Dalam dunia kimia, terdapat dua jenis reaksi yang sangat penting untuk dipahami, yaitu reaksi endoterm dan eksoterm. Kedua jenis reaksi ini memiliki perbedaan mendasar dalam hal perubahan energi yang terjadi saat reaksi berlangsung. Pada artikel ini, kita akan membahas secara detail perbedaan antara reaksi endoterm dan eksoterm, serta contoh-contoh nyata dari masing-masing jenis reaksi tersebut.
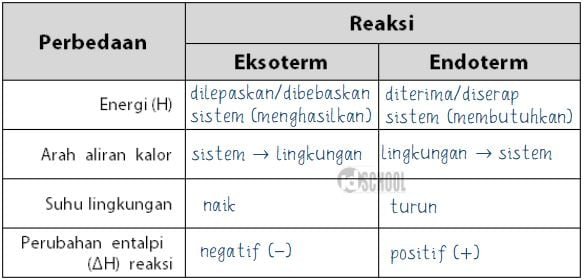
Reaksi endoterm dan eksoterm berkaitan erat dengan perubahan energi yang terjadi selama reaksi kimia. Reaksi endoterm adalah reaksi yang memerlukan energi tambahan untuk terjadi, sedangkan reaksi eksoterm adalah reaksi yang melepaskan energi ke sekitarnya. Perbedaan utama antara kedua jenis reaksi ini terletak pada arah aliran energi saat reaksi berlangsung.
Definisi Endoterm dan Eksoterm
Reaksi endoterm dan eksoterm adalah dua jenis reaksi kimia yang berbeda dalam hal perubahan energi yang terjadi. Reaksi endoterm adalah reaksi yang membutuhkan energi tambahan untuk terjadi, sedangkan reaksi eksoterm adalah reaksi yang melepaskan energi ke sekitarnya. Dalam reaksi endoterm, energi diserap dari lingkungan sekitar, sedangkan dalam reaksi eksoterm, energi dilepaskan ke lingkungan sekitar. Perbedaan ini dapat dijelaskan dengan konsep perubahan energi dalam reaksi kimia.
Perubahan Energi dalam Reaksi Endoterm
Dalam reaksi endoterm, energi diserap dari lingkungan sekitar untuk merubah reaktan menjadi produk. Dalam proses ini, energi kinetik dan energi potensial molekul reaktan meningkat. Perubahan energi dalam reaksi endoterm direpresentasikan dengan nilai entalpi positif (+ΔH). Sebagai contoh, reaksi pembakaran kayu adalah reaksi endoterm. Kayu membutuhkan panas tambahan (energi) untuk terbakar dan menghasilkan energi panas yang dilepaskan ke lingkungan.
Perubahan Energi dalam Reaksi Eksoterm
Dalam reaksi eksoterm, energi dilepaskan ke lingkungan sekitar saat reaktan berubah menjadi produk. Dalam proses ini, energi kinetik dan energi potensial molekul reaktan menurun. Perubahan energi dalam reaksi eksoterm direpresentasikan dengan nilai entalpi negatif (-ΔH). Sebagai contoh, reaksi pembakaran gas alam adalah reaksi eksoterm. Gas alam melepaskan panas (energi) saat terbakar dan menghasilkan energi panas yang dilepaskan ke lingkungan sekitar.
Proses dan Contoh Reaksi Endoterm
Proses terjadinya reaksi endoterm melibatkan penyerapan energi dari lingkungan sekitar. Energi ini digunakan untuk memecah ikatan molekul dalam reaktan, sehingga energi kinetik dan energi potensial molekul meningkat. Contoh nyata dari reaksi endoterm adalah fotosintesis, reaksi kimia yang terjadi pada tumbuhan hijau. Dalam fotosintesis, tumbuhan menggunakan energi cahaya matahari untuk mengubah air dan karbon dioksida menjadi glukosa dan oksigen. Proses ini membutuhkan energi tambahan dalam bentuk cahaya matahari untuk terjadi.
Penyerapan Energi dalam Reaksi Endoterm
Reaksi endoterm memerlukan penyerapan energi dalam bentuk panas, cahaya, atau energi lainnya dari lingkungan sekitar. Penyerapan energi ini diperlukan untuk memecah ikatan molekul dalam reaktan, yang membutuhkan energi tambahan. Contoh lain dari reaksi endoterm adalah pencairan es. Saat es mencair menjadi air, energi panas dari lingkungan diserap oleh es untuk memecahkan ikatan antar molekul air dalam latticenya.
Penerapan Reaksi Endoterm dalam Kehidupan Sehari-hari
Reaksi endoterm memiliki berbagai penerapan dalam kehidupan sehari-hari. Salah satu contohnya adalah pembekuan makanan. Saat makanan dibekukan, energi panas ditarik keluar dari makanan untuk membentuk kristal es dalamnya. Proses ini membantu mempertahankan kesegaran dan kualitas makanan yang dibekukan. Reaksi endoterm juga digunakan dalam proses penggumpalan beton, reaksi kimia dalam baterai pengisian ulang, dan dalam proses pendinginan dalam industri petrokimia.
Proses dan Contoh Reaksi Eksoterm
Proses terjadinya reaksi eksoterm melibatkan pelepasan energi ke lingkungan sekitar. Energi ini dilepaskan saat ikatan molekul dalam reaktan pecah dan membentuk ikatan baru dalam produk. Contoh nyata dari reaksi eksoterm adalah reaksi pembakaran. Saat bahan bakar terbakar, energi panas dilepaskan ke lingkungan sekitar.
Pelepasan Energi dalam Reaksi Eksoterm
Reaksi eksoterm melepaskan energi dalam bentuk panas, cahaya, atau energi lainnya ke lingkungan sekitar. Pelepasan energi ini terjadi karena pembentukan ikatan baru dalam produk lebih stabil dari ikatan molekul dalam reaktan. Contoh lain dari reaksi eksoterm adalah reaksi penguraian hidrogen peroksida dengan bantuan katalisator. Saat hidrogen peroksida menguraikan menjadi air dan oksigen, energi panas dilepaskan ke lingkungan sekitar.
Penerapan Reaksi Eksoterm dalam Kehidupan Sehari-hari
Reaksi eksoterm memiliki berbagai penerapan dalam kehidupan sehari-hari. Salah satu contohnya adalah dalam pembakaran bahan bakar. Ketika bahan bakar seperti bensin atau kayu terbakar, energi panas dilepaskan dan digunakan untuk menghasilkan tenaga, seperti dalam mesin pembakaran dalam mobil atau dalam kompor untuk memasak. Reaksi eksoterm juga terjadi dalam tubuh manusia saat makanan dicerna dan dalam proses respirasi. Selain itu, reaksi eksoterm digunakan dalam proses pembuatan keramik, produksi pupuk, dan dalam berbagai industri kimia.
Perbedaan dalam Perubahan Energi
Perbedaan utama antara reaksi endoterm dan eksoterm terletak pada perubahan energi yang terjadi selama reaksi berlangsung. Dalam reaksi endoterm, energi diserap dari lingkungan sekitar, sedangkan dalam reaksi eksoterm, energi dilepaskan ke lingkungan sekitar. Perubahan energi dalam reaksi kimia direpresentasikan dengan nilai entalpi.
Entalpi dalam Reaksi Endoterm
Entalpi adalah ukuran energi total dalam sistem kimia. Dalam reaksi endoterm, nilai entalpi menjadi positif (+ΔH) karena energi ditambahkan ke sistem untuk merubah reaktan menjadi produk. Nilai entalpi positif ini mencerminkan penyerapan energi dalam reaksi endoterm.
Entalpi dalam Reaksi Eksoterm
Entalpi dalam reaksi eksoterm memiliki nilai negatif (-ΔH) karena energi dilepaskan dari sistem saat reaktan berubah menjadi produk. Nilai entalpi negatif ini mencerminkan pelepasan energi dalam reaksi eksoterm.
Faktor-faktor yang Mempengaruhi Jenis Reaksi
Tidak semua reaksi kimia dapat dikategorikan secara jelas sebagai endoterm atau eksoterm. Beberapa faktor dapat mempengaruhi jenis reaksi yang terjadi, seperti konsentrasi zat, suhu, dan katalisator
Pengaruh Konsentrasi Zat
Konsentrasi zat dapat mempengaruhi jenis reaksi yang terjadi. Pada beberapa reaksi, peningkatan konsentrasi zat dapat memicu reaksi endoterm menjadi eksoterm, atau sebaliknya. Misalnya, dalam reaksi kimia antara asam dan basa, jika konsentrasi asam atau basa ditingkatkan, reaksi yang sebelumnya eksoterm dapat menjadi endoterm. Hal ini terjadi karena peningkatan konsentrasi zat menyebabkan perubahan dalam keadaan energi sistem.
Pengaruh Suhu
Suhu juga merupakan faktor yang mempengaruhi jenis reaksi yang terjadi. Pada umumnya, peningkatan suhu akan meningkatkan laju reaksi. Namun, dalam beberapa kasus, peningkatan suhu juga dapat mengubah jenis reaksi dari endoterm menjadi eksoterm atau sebaliknya. Misalnya, reaksi pembentukan amonia adalah reaksi endoterm. Namun, pada suhu yang sangat tinggi, reaksi ini menjadi eksoterm. Penambahan energi panas dalam bentuk suhu tinggi mengubah perubahan energi dari positif menjadi negatif.
Pengaruh Katalisator
Katalisator adalah zat yang mempercepat laju reaksi kimia tanpa ikut bereaksi secara permanen. Katalisator dapat mempengaruhi jenis reaksi yang terjadi. Pada umumnya, katalisator tidak mengubah jenis reaksi dari endoterm menjadi eksoterm atau sebaliknya. Namun, katalisator dapat mengurangi energi aktivasi yang diperlukan dalam reaksi, sehingga reaksi dapat berlangsung dengan lebih efisien. Dalam hal ini, katalisator tidak mempengaruhi perubahan energi yang terjadi selama reaksi, tetapi mempercepat laju reaksi tersebut.
Dampak Reaksi Endoterm dan Eksoterm dalam Kehidupan Sehari-hari
Reaksi endoterm dan eksoterm memiliki dampak yang signifikan dalam kehidupan sehari-hari. Dalam industri dan aplikasi teknologi, pemahaman tentang kedua jenis reaksi ini sangat penting untuk pengembangan dan penggunaan berbagai produk dan proses.
Pembuatan Makanan dan Minuman
Dalam industri makanan dan minuman, reaksi endoterm dan eksoterm digunakan dalam berbagai proses produksi. Misalnya, dalam proses pemanggangan roti atau kue, reaksi eksoterm terjadi saat adonan terpapar panas dan menghasilkan roti atau kue yang matang dan berwarna kecoklatan. Di sisi lain, dalam pembuatan es krim, reaksi endoterm terjadi saat campuran bahan-bahan dingin seperti susu dan gula dimasukkan ke dalam mesin es krim yang menghasilkan produk akhir yang lezat dan dingin.
Pembangkitan Energi Listrik
Reaksi eksoterm memiliki peran penting dalam pembangkitan energi listrik. Pembangkit listrik tenaga panas, seperti pembangkit listrik tenaga uap atau pembangkit listrik tenaga nuklir, menggunakan reaksi eksoterm dalam prosesnya. Pemanasan air menjadi uap dalam boiler atau penggunaan reaksi nuklir dalam reaktor nuklir menghasilkan energi panas yang kemudian dikonversi menjadi energi listrik melalui turbin dan generator.
Industri Kimia dan Farmasi
Reaksi endoterm dan eksoterm juga digunakan dalam berbagai industri kimia dan farmasi. Dalam industri kimia, reaksi endoterm digunakan dalam proses produksi seperti produksi pupuk, pembuatan keramik, atau produksi bahan kimia tertentu. Sementara itu, reaksi eksoterm digunakan dalam produksi bahan kimia lain, seperti produksi plastik atau pembuatan obat-obatan. Pemahaman tentang jenis reaksi ini memungkinkan pengembangan proses yang efisien dan aman dalam industri ini.
Jenis Reaksi dalam Kehidupan Sehari-hari
Dalam kehidupan sehari-hari, terdapat berbagai jenis reaksi kimia yang sering terjadi dan dapat diklasifikasikan sebagai endoterm atau eksoterm. Pemahaman tentang jenis reaksi ini dapat membantu kita dalam memahami berbagai fenomena kimia yang terjadi di sekitar kita.
Reaksi Oksidasi dan Reduksi
Reaksi oksidasi dan reduksi adalah jenis reaksi kimia yang sering terjadi dalam kehidupan sehari-hari. Reaksi ini dapat diklasifikasikan sebagai endoterm atau eksoterm tergantung pada kondisi reaksi. Misalnya, reaksi pembakaran kayu adalah reaksi eksoterm, sedangkan reaksi elektrolisis, yang terjadi dalam baterai, adalah reaksi endoterm.
Reaksi Asam dan Basa
Reaksi asam dan basa juga merupakan jenis reaksi kimia yang sering terjadi. Reaksi netralisasi antara asam dan basa dapat diklasifikasikan sebagai reaksi eksoterm. Misalnya, reaksi antara asam klorida dan natrium hidroksida menghasilkan air dan garam, dan reaksi ini melepaskan energi panas ke lingkungan sekitar.
Reaksi Penguraian
Reaksi penguraian adalah reaksi kimia di mana suatu zat terurai menjadi zat-zat yang lebih sederhana. Reaksi ini dapat diklasifikasikan sebagai endoterm atau eksoterm tergantung pada kondisi reaksi. Misalnya, reaksi penguraian hidrogen peroksida adalah reaksi eksoterm, sedangkan reaksi penguraian amonium nitrat adalah reaksi endoterm.
Keberlanjutan Energi dalam Reaksi
Keberlanjutan energi merupakan konsep penting dalam memahami reaksi kimia. Dalam konteks reaksi endoterm dan eksoterm, keberlanjutan energi merujuk pada bagaimana energi dapat dilestarikan atau diubah selama reaksi berlangsung.
Peran Energis Pada Keberlanjutan
Pemahaman tentang peran energi dalam reaksi endoterm dan eksoterm dapat membantu kita dalam mengembangkan proses yang lebih efisien dan berkelanjutan. Dalam industri, peningkatan efisiensi reaksi endoterm dan eksoterm dapat mengurangi penggunaan energi dan emisi karbon, menjadikan proses produksi lebih berkelanjutan. Selain itu, pemahaman tentang perubahan energi dalam reaksi juga dapat membantu dalam pengembangan teknologi energi terbarukan, seperti penggunaan energi matahari atau energi angin.
Kesimpulan
Dalam artikel ini, kita telah membahas secara detail perbedaan antara reaksi endoterm dan eksoterm. Kedua jenis reaksi ini memiliki perbedaan dalam hal perubahan energi yang terjadi saat reaksi berlangsung. Reaksi endoterm memerlukan energi tambahan untuk terjadi, sedangkan reaksi eksoterm melepaskan energi ke lingkungan sekitar. Pemahaman tentang perbedaan ini penting dalam memahami berbagai fenomena kimia dalam kehidupan sehari-hari, serta dalam pengembangan teknologi dan industri kimia yang lebih efisien dan berkelanjutan.
Dengan memahami perbedaan antara reaksi endoterm dan eksoterm, kita dapat memiliki pemahaman yang lebih mendalam tentang dunia kimia dan bagaimana reaksi kimia mempengaruhi kehidupan sehari-hari. Semoga artikel ini dapat memberikan wawasan yang berguna dan mendukung pengembangan pengetahuan kita dalam bidang ini.
