Perbedaan reaksi endoterm dan eksoterm merupakan konsep penting dalam ilmu kimia yang dapat membantu kita memahami perubahan energi yang terjadi selama suatu reaksi kimia. Dalam tulisan ini, kami akan memberikan penjelasan yang lebih rinci tentang reaksi endoterm dan eksoterm, serta membandingkan perbedaan antara keduanya. Kami juga akan memberikan contoh-contoh yang dapat membantu Anda memahami konsep ini dengan lebih baik.
Definisi Reaksi Endoterm
Reaksi endoterm adalah jenis reaksi kimia di mana energi diserap atau diambil dari sekitarnya selama proses reaksi. Dalam reaksi endoterm, energi potensial kimia dalam sistem meningkat, sementara energi kinetik dari lingkungan sekitar berkurang. Hal ini dapat mengakibatkan penurunan suhu lingkungan saat reaksi berlangsung. Reaksi endoterm dapat terjadi karena adanya pembentukan ikatan kimia yang memerlukan energi atau reaksi yang memisahkan ikatan kimia yang melepaskan energi. Contoh umum reaksi endoterm adalah elektrolisis air, dekomposisi amonium nitrat, dan penguapan air.
Persamaan Reaksi Endoterm
Reaksi endoterm dapat ditulis dalam bentuk persamaan kimia yang menggambarkan perubahan energi yang terjadi. Sebagai contoh, persamaan reaksi untuk elektrolisis air adalah:
2H2O(l) + energi listrik → 2H2(g) + O2(g)
Dalam reaksi ini, energi listrik digunakan untuk memecah molekul air (H2O) menjadi gas hidrogen (H2) dan gas oksigen (O2). Energi listrik yang digunakan dalam reaksi ini adalah bentuk energi yang diambil dari sekitar, sehingga menjadikannya reaksi endoterm.
Contoh Lain Reaksi Endoterm
Beberapa contoh lain reaksi endoterm meliputi:
- Dekomposisi Amonium Nitrat (NH4NO3)
Dalam reaksi ini, amonium nitrat terurai menjadi nitrogen oksida (NO) dan air (H2O). Proses dekomposisi ini memerlukan panas untuk memecah ikatan kimia dalam amonium nitrat, sehingga menjadikannya reaksi endoterm.
- Penguapan Air (H2O)
Proses penguapan air melibatkan perubahan fase dari cair menjadi gas. Dalam proses ini, energi panas diperlukan untuk mengubah air menjadi uap air. Energi panas ini diambil dari sekitar, sehingga menjadikannya reaksi endoterm.
Definisi Reaksi Eksoterm
Reaksi eksoterm adalah jenis reaksi kimia di mana energi dilepaskan atau dilepaskan ke lingkungan sekitarnya selama proses reaksi. Dalam reaksi eksoterm, energi potensial kimia dalam sistem berkurang, sementara energi kinetik dari lingkungan sekitar meningkat. Hal ini dapat mengakibatkan peningkatan suhu lingkungan saat reaksi berlangsung. Reaksi eksoterm sering kali terjadi ketika ikatan kimia terbentuk atau ketika reaksi kimia menghasilkan produk yang lebih stabil secara termodinamika. Contoh umum reaksi eksoterm adalah pembakaran kayu, reaksi antara asam dan logam, dan respirasi.
Persamaan Reaksi Eksoterm
Reaksi eksoterm juga dapat ditulis dalam bentuk persamaan kimia yang menggambarkan perubahan energi yang terjadi. Sebagai contoh, persamaan reaksi untuk pembakaran kayu adalah:
C6H12O6(s) + 6O2(g) → 6CO2(g) + 6H2O(g) + energi
Dalam reaksi ini, kayu (C6H12O6) bereaksi dengan oksigen (O2) dalam udara untuk menghasilkan gas karbon dioksida (CO2), gas air (H2O), dan energi panas. Energi panas yang dihasilkan dalam reaksi ini dilepaskan ke lingkungan sekitar, menjadikannya reaksi eksoterm.
Contoh Lain Reaksi Eksoterm
Beberapa contoh lain reaksi eksoterm meliputi:
- Reaksi Antara Asam dan Logam
Reaksi antara asam, seperti asam klorida (HCl), dan logam, seperti seng (Zn), menghasilkan gas hidrogen (H2) dan panas. Proses ini melepaskan energi panas ke lingkungan sekitar, menjadikannya reaksi eksoterm.
- Respirasi
Respirasi adalah proses di mana organisme mengubah makanan menjadi energi yang dapat digunakan untuk beraktivitas. Dalam proses ini, makanan dipecah menjadi komponen yang lebih sederhana, seperti glukosa, yang kemudian bereaksi dengan oksigen dalam tubuh untuk menghasilkan energi, karbon dioksida, dan air. Energi yang dihasilkan dalam proses respirasi dilepaskan ke lingkungan sekitar, menjadikannya reaksi eksoterm.
Perbedaan dalam Perubahan Energi
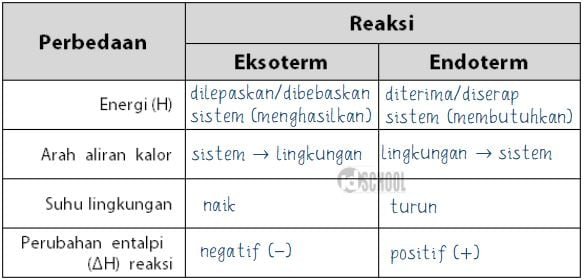
Perbedaan utama antara reaksi endoterm dan eksoterm terletak pada perubahan energi yang terjadi selama reaksi. Dalam reaksi endoterm, energi diserap atau diambil dari sekitarnya, sehingga menghasilkan perubahan energi positif. Dalam reaksi eksoterm, energi dilepaskan atau dilepaskan ke lingkungan sekitarnya, sehingga menghasilkan perubahan energi negatif.
Perubahan Energi pada Reaksi Endoterm
Pada reaksi endoterm, energi yang diserap atau diambil dari sekitarnya digunakan untuk memecah ikatan kimia dalam reaktan dan membentuk ikatan baru dalam produk. Hal ini menyebabkan energi potensial kimia dalam sistem meningkat. Dalam grafik energi, reaksi endoterm ditunjukkan dengan adanya puncak energi potensial yang lebih tinggi pada produk dibandingkan dengan reaktan. Perubahan energi dalam reaksi endoterm adalah positif, karena energi diserap oleh sistem.
Perubahan Energi pada Reaksi Eksoterm
Pada reaksi eksoterm, energi yang dilepaskan atau dilepaskan ke lingkungan sekitarnya digunakan untuk membentuk ikatan kimia dalam produk dan memutus ikatan kimia dalam reaktan. Hal ini menyebabkan energi potensial kimia dalam sistem berkurang. Dalam grafik energi, reaksi eksoterm ditunjukkan dengan adanya puncak energi potensial yang lebih tinggi pada reaktan dibandingkan dengan produk. Perubahan energi dalam reaksi eksoterm adalah negatif, karena energi dilepaskan oleh sistem.
Perubahan Suhu Lingkungan
Reaksi endoterm menyebabkan suhu lingkungan sekitar menurun karena energi diambil dari lingkungan. Pada awalnya, reaksi endoterm dapat menyebabkan suhu lingkungan sekitar menjadi dingin. Namun, seiring berjalannya reaksi, suhu lingkungan akan kembali normal atau bahkan sedikit meningkat karena energi yang dilepaskan oleh sistem. Oleh karena itu, suhu lingkungan umumnya akan menunjukkan penurunan sementara selama reaksi endoterm berlangsung.
Di sisi lain, reaksi eksoterm menyebabkan suhu lingkungan sekitar meningkat karena energi dilepaskan ke lingkungan. Proses ini menghasilkan panas yang dirasakan sebagai kenaikan suhu lingkungan sekitar. Oleh karena itu, suhu lingkungan umumnya akan menunjukkan peningkatan selama reaksi eksoterm berlangsung.
Kecepatan Reaksi
Kecepatan reaksi endoterm dan eksoterm dipengarungaruhi oleh suhu lingkungan. Namun, pengaruhnya berbeda antara keduanya.
Kecepatan Reaksi Endoterm
Pada umumnya, kecepatan reaksi endoterm cenderung meningkat dengan peningkatan suhu lingkungan. Hal ini karena semakin tinggi suhu lingkungan, semakin banyak energi yang dapat diserap oleh sistem. Dengan peningkatan energi, molekul-molekul reaktan menjadi lebih bergerak dan memiliki energi kinetik yang lebih tinggi. Ini memungkinkan terjadinya lebih banyak tumbukan efektif antara molekul-molekul reaktan, yang mempercepat kecepatan reaksi. Namun, perlu dicatat bahwa peningkatan suhu lingkungan tidak selalu menghasilkan peningkatan kecepatan reaksi endoterm yang signifikan. Ada batas tertentu di mana kecepatan reaksi mencapai titik jenuh dan tidak bertambah dengan peningkatan suhu lebih lanjut.
Kecepatan Reaksi Eksoterm
Kecepatan reaksi eksoterm dapat berkurang dengan peningkatan suhu lingkungan. Meskipun peningkatan suhu meningkatkan energi kinetik molekul-molekul reaktan, pada beberapa kasus, peningkatan suhu dapat mengurangi kecepatan reaksi eksoterm. Hal ini terjadi karena peningkatan suhu juga meningkatkan energi kinetik molekul-molekul produk yang terbentuk. Dengan energi kinetik yang lebih tinggi, molekul-molekul produk cenderung bergerak lebih cepat dan lebih aktif. Akibatnya, molekul-molekul produk dapat lebih sering bertabrakan dengan molekul-molekul reaktan, mencegah terjadinya tumbukan efektif yang diperlukan untuk reaksi. Oleh karena itu, kecepatan reaksi eksoterm bisa lebih lambat dengan peningkatan suhu lingkungan tertentu.
Kurva Energi
Kurva energi adalah grafik yang menggambarkan perubahan energi yang terjadi selama suatu reaksi kimia. Dalam reaksi endoterm, bentuk kurva energi memiliki karakteristik yang berbeda dengan reaksi eksoterm.
Kurva Energi Reaksi Endoterm
Pada kurva energi reaksi endoterm, energi awal reaktan (Ea) lebih rendah daripada energi akhir produk (Ep). Ini menunjukkan bahwa energi harus diserap atau diambil dari sekitar selama reaksi untuk membentuk produk yang lebih tinggi dalam energi. Pada titik tertinggi kurva energi, terdapat puncak energi potensial yang menandakan energi yang diperlukan untuk melampaui ambang aktivasi dan memulai reaksi. Setelah melewati ambang aktivasi, energi potensial sistem mulai meningkat dan mencapai energi akhir yang lebih tinggi pada produk.
Kurva Energi Reaksi Eksoterm
Pada kurva energi reaksi eksoterm, energi awal reaktan (Ea) lebih tinggi daripada energi akhir produk (Ep). Ini menunjukkan bahwa energi dilepaskan atau dilepaskan ke lingkungan sekitar selama reaksi. Pada titik tertinggi kurva energi, terdapat puncak energi potensial yang menandakan energi yang diperlukan untuk melampaui ambang aktivasi dan memulai reaksi. Setelah melewati ambang aktivasi, energi potensial sistem mulai menurun dan mencapai energi akhir yang lebih rendah pada produk.
Contoh Reaksi Endoterm
Reaksi endoterm memiliki banyak contoh dalam kehidupan sehari-hari. Beberapa contoh reaksi endoterm yang umum meliputi:
Elektrolisis Air (H2O)
Dalam elektrolisis air, energi listrik diperlukan untuk memecah molekul air menjadi oksigen (O2) dan hidrogen (H2). Reaksi ini membutuhkan energi untuk memutus ikatan-ikatan antara atom hidrogen dan oksigen dalam air, sehingga menjadikannya reaksi endoterm. Elektrolisis air digunakan dalam berbagai aplikasi, termasuk dalam proses produksi hidrogen dan oksigen murni.
Dekomposisi Amonium Nitrat (NH4NO3)
Dalam dekomposisi amonium nitrat, panas diperlukan untuk memecah amonium nitrat menjadi nitrogen oksida (NO) dan air (H2O). Reaksi ini membutuhkan energi untuk memutus ikatan-ikatan dalam amonium nitrat, sehingga menjadikannya reaksi endoterm. Amonium nitrat sering digunakan sebagai pupuk dan juga dalam industri peledak.
Penguapan Air (H2O)
Pada suhu dan tekanan tertentu, air dapat menguap menjadi uap air. Proses ini membutuhkan energi panas untuk mengubah air menjadi uap air. Energi panas yang diperlukan dalam proses penguapan diambil dari sekitar, sehingga menjadikannya reaksi endoterm. Penguapan air adalah fenomena yang umum terjadi dalam kehidupan sehari-hari, seperti saat air menguap dari permukaan laut, dan juga digunakan dalam industri pengolahan makanan dan produksi uap air.
Contoh Reaksi Eksoterm
Reaksi eksoterm juga memiliki berbagai contoh yang dapat ditemukan dalam kehidupan sehari-hari. Beberapa contoh reaksi eksoterm yang umum meliputi:
Pembakaran Kayu
Dalam pembakaran kayu, kayu bereaksi dengan oksigen (O2) dalam udara dan menghasilkan panas serta gas karbon dioksida (CO2) dan uap air (H2O). Reaksi ini melepaskan energi panas ke lingkungan sekitar, menjadikannya reaksi eksoterm. Pembakaran kayu digunakan sebagai sumber panas dalam berbagai aplikasi, termasuk pemanasan rumah dan memasak makanan.
Reaksi Antara Asam dan Logam
Reaksi kimia antara asam, seperti asam klorida (HCl), dan logam, seperti seng (Zn), menghasilkan gas hidrogen (H2) dan panas. Logam bereaksi dengan asam untuk membentuk garam dan melepaskan hidrogen. Panas yang dihasilkan dalam reaksi ini dilepaskan ke lingkungan sekitar, menjadikannya reaksi eksoterm. Reaksi antara asam dan logam digunakan dalam berbagai aplikasi, termasuk dalam produksi gas hidrogen dan dalam eksperimen kimia.
Respirasi
Respirasi adalah proses di mana organisme mengubah makanan menjadi energi yang dapat digunakan untuk beraktivitas. Dalam proses ini, makanan dipecah menjadi komponen yang lebih sederhana, seperti glukosa, yang kemudian bereaksi dengan oksigen dalam tubuh untuk menghasilkan energi, karbon dioksida (CO2), dan air (H2O). Energi yang dihasilkan dalam proses respirasi dilepaskan ke lingkungan sekitar, menjadikannya reaksi eksoterm. Respirasi merupakan proses vital dalam semua makhluk hidup, termasuk manusia dan hewan.
Penerapan dalam Kehidupan Sehari-hari
Perbedaan antara reaksi endoterm dan eksoterm memiliki banyak penerapan dalam kehidupan sehari-hari. Beberapa contoh penerapannya meliputi:
Pemanas Ruangan dan Oven
Pemanas ruangan dan oven menggunakan reaksi eksoterm untuk menghasilkan panas. Misalnya, pemanas ruangan menggunakan bahan bakar seperti gas alam atau minyak yang bereaksi dengan oksigen dalam udara untuk menghasilkan panas yang memanaskan udara di dalam ruangan. Oven juga menggunakan reaksi eksoterm, di mana bahan bakar atau sumber panas lainnya digunakan untuk memanaskan ruang dalam oven. Dalam kedua kasus, energi panas dilepaskan ke lingkungan sekitar, menjadikan pemanas ruangan dan oven sebagai contoh penerapan reaksi eksoterm dalam kehidupan sehari-hari.
Pendingin Udara
Pendingin udara menggunakan reaksi endoterm untuk menyerap panas dari udara sekitar dan menghasilkan udara yang lebih dingin. Pendingin udara bekerja dengan memampatkan dan mengembangkan refrigeran, yang merupakan zat yang mengalami perubahan fase dari cair menjadi gas dan sebaliknya. Saat refrigeran mengalami perubahan fase dari gas menjadi cair, ia menyerap panas dari udara sekitar, mendinginkan udara. Proses ini membutuhkan energi panas yang diambil dari lingkungan sekitar, menjadikannya contoh penerapan reaksi endoterm dalam kehidupan sehari-hari.
Pembuatan Es
Dalam proses pembuatan es, air cair diubah menjadi es melalui reaksi endoterm. Air cair ditempatkan dalam freezer atau mesin pembuat es, di mana suhu lingkungan sangat rendah. Selama proses pembekuan, air cair menyerap panas dari lingkungan sekitar untuk menjadi es. Energi panas yang diperlukan dalam proses ini diambil dari sekitar, menjadikannya contoh penerapan reaksi endoterm dalam kehidupan sehari-hari.
Kesimpulan
Dalam ilmu kimia, perbedaan reaksi endoterm dan eksoterm merupakan konsep penting untuk memahami perubahan energi yang terjadi selama suatu reaksi kimia. Reaksi endoterm mengabsorbsi energi dari sekitarnya, sementara reaksi eksoterm melepaskan energi ke lingkungan sekitarnya. Perubahan energi, suhu lingkungan, kecepatan reaksi, dan bentuk kurva energi adalah beberapa aspek yang membedakan kedua jenis reaksi ini. Memahami perbedaan ini dapat membantu kita memahami berbagai fenomena kimia di dunia sekitar kita. Contoh-contoh reaksi endoterm dan eksoterm dalam kehidupan sehari-hari juga menunjukkan betapa pentingnya pemahaman tentang konsep ini dalam aplikasi praktis. Dengan pemahaman yang baik tentang reaksi endoterm dan eksoterm, kita dapat lebih memahami dan mengendalikan perubahan energi dalam berbagai proses kimia maupun fenomena alam.
